新冠疫情后,疫苗开发迎来了变革期。在2024-2025这一关键节点,全球疫苗产业在传统平台优化与新型平台迭代上同步加速。整体疫苗开发正朝着“通用化、可及化、智能化”方向迈进。
在此行业快速扩充的关口,我们尝试对2024-2025期间,新型疫苗及传统疫苗的突破性进展进行了整体梳理,尤其是已经迈入临床转化或商业化阶段的高价值项目,力图以全球性的眼光,观察未来疫苗行业的腾飞新方向。
一、新型疫苗平台快速迭代
2024-2025年间,新型疫苗技术迎来了加速应用与产业化突破。在2024-2025年间,国内RNA疫苗(mRNA/circRNA/saRNA)获批临床项目近20项,进入“多病种切入”“版本更新”阶段。重组亚单位疫苗及病毒样颗粒(VLP)平台也通过配方更新、佐剂与结构设计等,继续在监管与覆盖能力上取得实质性进展。
RNA疫苗(mRNA/circRNA/saRNA)
2024年5月1日—University of Florida(UF Health Cancer Center)团队发布其mRNA疫苗用于脑瘤(glioblastoma)治疗的初步人体研究成果[1]。该团队开发了一种基于mRNA的肿瘤疫苗(使用患者自身肿瘤细胞信息+复杂递送机制)并在成人患者中观察到“在48小时内使肿瘤从免疫冷态变为免疫热态”的免疫反应。对mRNA平台而言,它标志着mRNA疫苗不仅限于传染病防控,还可用于复杂肿瘤免疫治疗,体现平台通用性的突破。也说明mRNA的递送和免疫激活机制正被重大改进。
对于circRNA而言,最大的突破性进展莫过于连续三个项目进入临床阶段,原研单位均来自中国。转录本生物放射性口干症的临床项目于2024年10月份获批,环码生物用于治疗缺血性心脏病环状RNA项目于2025年1月获批临床,圆因生物环状RNA药物TI-0093注射液于2025年8月获临床试验默示许可,该项目用于治疗HPV16阳性的晚期复发或转移性实体瘤。临床项目的增多意味着在逐渐突破工艺的同时,质量研究也开始逐步完善。
相较于circRNA,saRNA进展更快,2023年11月,日本厚生劳动省批准了CSL与Arcturus therapeutics联合开发的自复制RNA(saRNA)新冠疫苗:ARCT-154(一款saRNA-LNP冻干制剂),是第一个获批上市的saRNA疫苗。2025年9月份,美国公司Replicate Bioscience公布了其狂犬病saRNA临床项目RBI-4000的8个月耐久性分析数据,在0.1–10 μg剂量方案下,在受试者中可在最长8个月仍检测到中和抗体,且用多种衰减模型比较显示其抗体半衰期与/或耐久性与传统灭活疫苗相当或更优[2]。证明了RNA平台向“更低剂量(成本)、更广覆盖”方向的可行性,是RNA平台从“短期应急”向“长期常规”转变的关键里程碑。
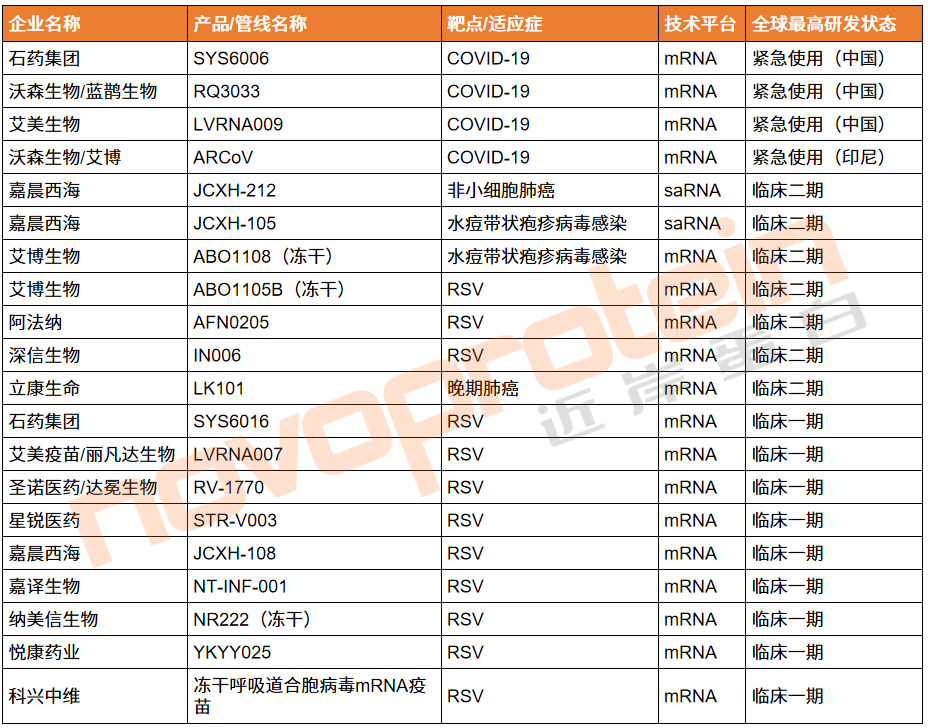
表1、截至目前国内获批紧急使用或进入临床的mRNA疫苗
(部分清单,novoprotein整理)
亚单位/重组蛋白疫苗
2024年8月30日,Novavax(公司)获得美国FDA对其更新配方蛋白/佐剂COVID-19疫苗的紧急使用授权(EUA)[3]。是蛋白/佐剂平台在法规层面被再次认可为主流抗 SARS-CoV-2的可用选项,表明蛋白疫苗(非mRNA)仍具快速迭代并被监管接受的能力。
2024年9月4日,Vaxcyte公司宣布其31价肺炎球菌结合疫苗(VAX-31)在一项针对1015名50岁及以上健康成人的1/2期临床试验中取得了积极结果,并决定推进至更高3期临床[4]。代表多价蛋白/结合疫苗通过扩大覆盖血清型(价型扩展)直接提升公共卫生价值,代表结合疫苗在覆盖率的竞争力上取得实质进展。
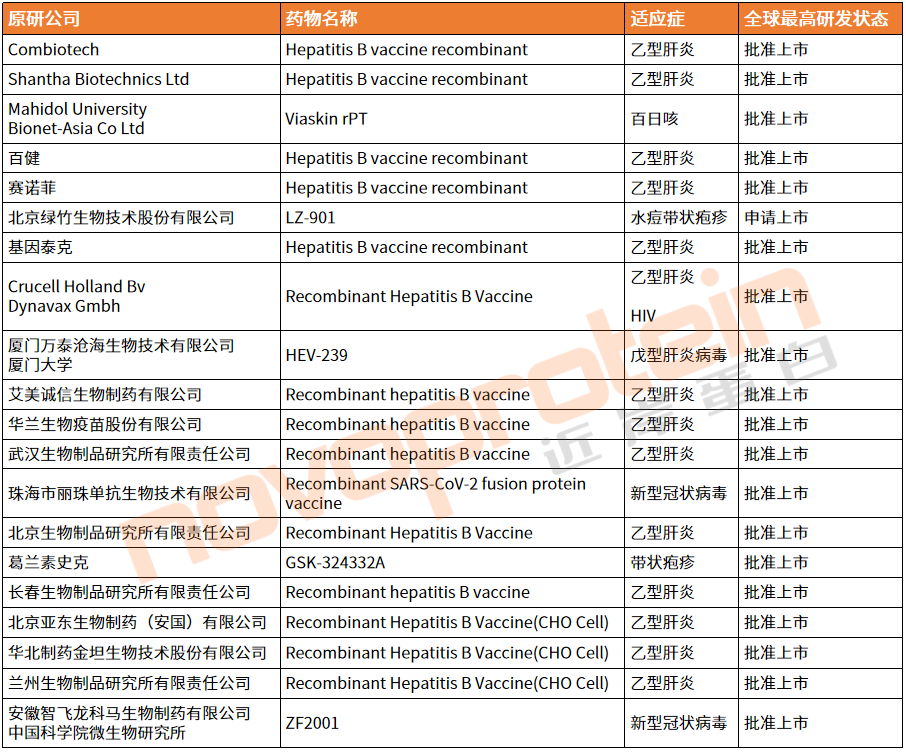
表2、截至目前进入商业化阶段的亚单位/重组蛋白疫苗
(部分清单,novoprotein整理)
病毒样颗粒疫苗(VLP)
VLP在2024–2025年的真正突破是由临床成功转向监管批准与商业化上市,实现质的飞跃。
2025年3月18日,Bavarian Nordic(公司)推出并在美欧获批商业化其VLP-based Chikungunya疫苗VIMKUNYA™用于12岁以上人群,并启动2-11岁儿童的第III期试验[5]。这是第一个以VLP技术在成人/青少年中获准并商业化的针对新兴病原体(Chikungunya)的疫苗,把VLP从“临床候选/研究”阶段推进到使用阶段,证明其在安全性与免疫原性上既能满足监管要求又具备商业化条件。
2024年2月19日,阿斯利康以11亿美元金额完成了对Icosavax公司的收购,并推进 IVX-A12(RSV+hMPV组合蛋白VLP疫苗)至临床中后期[6]。II期数据表明,IVX-A12在接种疫苗一个月后可引发针对RSV和hMPV强大免疫应答,该疫苗已进入到III期临床。大型制药公司对VLP平台的并购与推进说明VLP已被视为可产业化、可规模生产且商业价值明确的平台。对行业来说,意味着资本与产能将加速VLP的广泛应用。
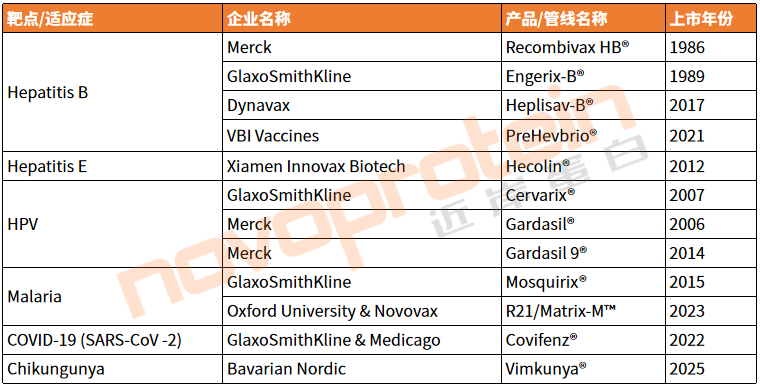
表3、截至目前进入商业化阶段的VLP疫苗
(novoprotein整理,如有错漏,欢迎指正)
二、传统疫苗平台的精进
在2024-2025年间,传统疫苗平台(如减毒/灭活/病毒载体等)虽然相较于新型疫苗平台显得“稳重”,但同样在给药方式、靶点拓展、特殊人群应用、监管规范化等方面有所突破,显著强化了作为“疫苗产业基本盘”的角色。下面列出几个突破性进展:
给药方式创新
2024年4月15日,牛津大学公布了通过气溶胶方式给予减毒版Tuberculosis疫苗(BCG疫苗)的一项人体挑战模型研究[7],研究中将BCG通过喷雾方式进入肺部,研究其在近似自然感染途径下的安全性与耐受性。这一研究强调传统减毒疫苗不仅在经典的“肌肉/皮下注射”路径上可靠,而且通过更接近病原自然侵入途径(肺部喷雾)进行的给药方式研究,代表了传统平台在“给药方式”与免疫原性增强上的改进。
靶点拓展
2024年9月10日,法国Valneva公司在《Journal of Travel Medicine》杂志上发表其基孔肯雅热减毒活疫苗VLA1553(IXCHIQ®)相关数据[8],随后该款疫苗成为第一款获得FDA批准的基孔肯雅热减毒病毒疫苗用于成人免疫。标志着减毒病毒疫苗平台在全球公共卫生病原体(蚊媒病毒)中的应用扩展,从传统的减毒疫苗(如麻疹、风疹)走向新的病毒类型,从而强化了减毒平台在“新病原/少有疫苗”领域中的价值。
免疫受损人群应用
2025年6月11日,由康希诺生物与中国军事医学科学院生物工程研究所共同研究的腺病毒5型载体的新冠疫苗(Ad5nCoV)在HIV感染者(PLWH)人群中进行研究,显示安全且免疫反应持续至少一年[9]。表明腺病毒载体平台正在扩展至免疫受损人群的应用,这加强了其在“高风险群体疫苗策略”中的地位。
监管规范化
2024年12月20日,中国国家药典委员会发布新版《多糖结合疫苗质量控制技术指南(征求意见稿)》,涉及多糖结合疫苗中“偶联工艺”“纯化工艺”“载体蛋白选择”等[10]。该指南的发布体现监管层面对多糖-蛋白结合疫苗平台的进一步规范与推动,意味着该平台进一步规范化。
未来,无论是新型疫苗还是传统疫苗,技术趋势都将持续向多病种覆盖与多平台融合发展。人工智能的快速进步,为疫苗从抗原设计、结构优化到免疫效果预测提高了研发效率。随着多技术平台的疫苗项目不断实现从早期研究到临床验证,再到商业化落地的突破,意味着在面对快速变异的病原体与潜在大流行时,人类将具备更敏捷的响应能力、更高的制造灵活性以及更可持续的免疫保障体系。这不仅代表疫苗研发范式的革新,也预示着疫苗产业正迈入一个以智能化、模块化的新阶段。
近岸蛋白加速新型疫苗疗法的研究开发与转化应用
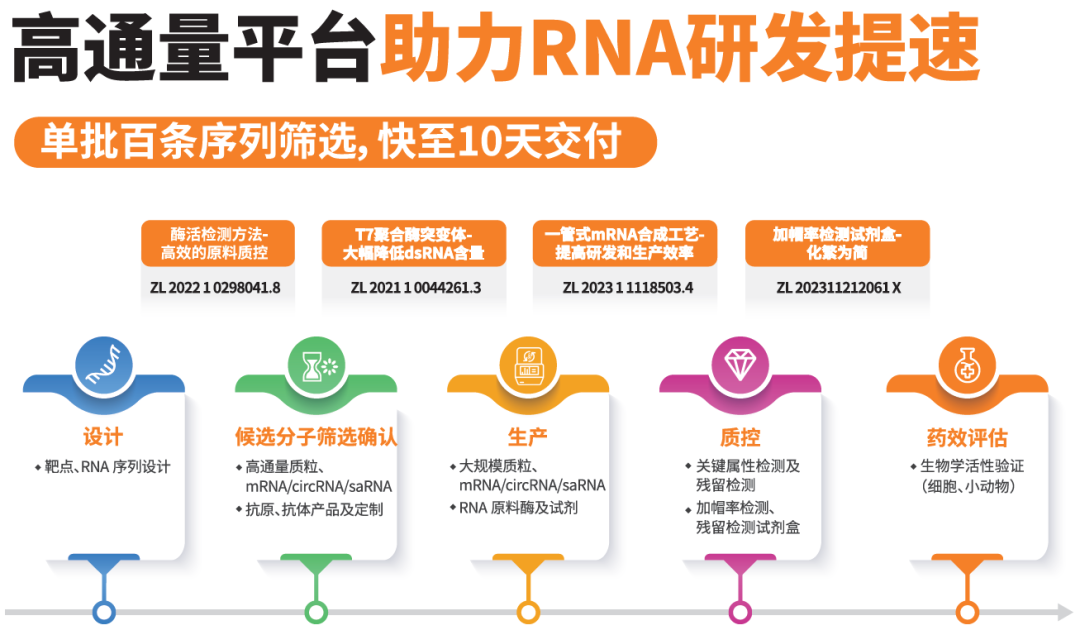
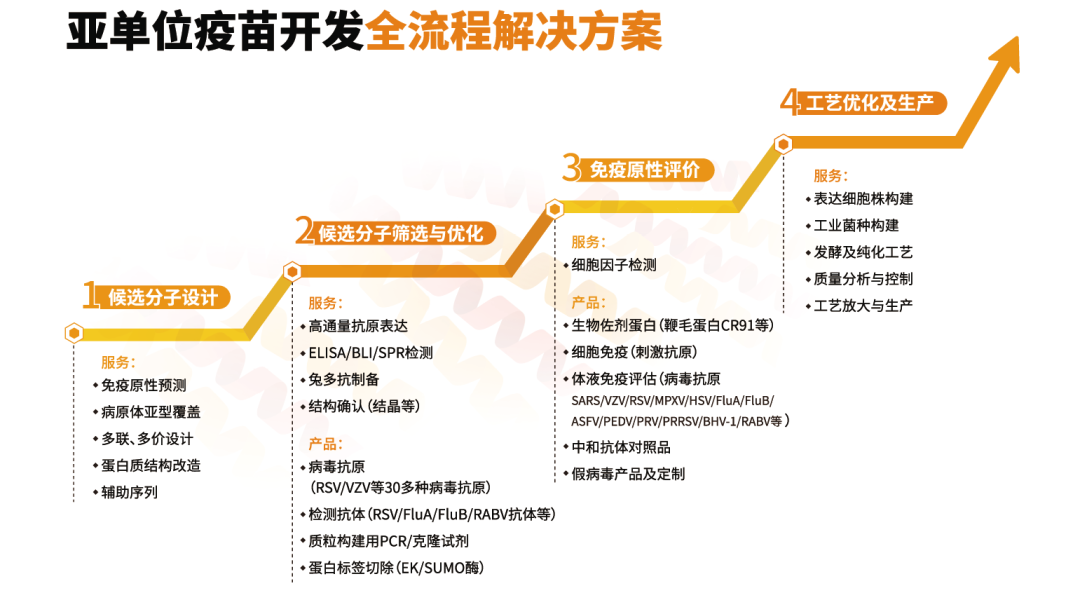
近岸蛋白提供新型疫苗研发过程中的全流程解决方案,涵盖RNA疫苗、亚单位疫苗、VLP疫苗多核心技术平台,具备从抗原设计、候选分子筛选、工艺建立,到质量控制与评价的能力,团队成员拥有多年人用与兽用疫苗开发经验。

11月14-16日,2025中国疫苗行业协会学术年会在福建厦门召开,本次大会将有中国疫苗行业各研究院所、高等院校、药物研发与生产企业等行业专家展开深入交流,设置了多个分会场主题。近岸蛋白诚邀您在厦门国际会议展览中心,B12展位进行交流。
RNA疫苗方面,近岸蛋白支持mRNA、circRNA、saRNA多种技术开发路线,覆盖从候选分子序列优化、通量筛选与生物学评估等过程服务,拥有GMP级T7 RNA聚合酶、加帽酶等关键原料,并完成全套产品FDA DMF备案,已助力20余家客户完成中美IND申报。
在亚单位疫苗开发中,近岸蛋白拥有计算机辅助抗原结构设计与蛋白分析改造能力,支持通过大肠杆菌、酵母、真核、昆虫多表达系统匹配小规模到放大生产。VLP疫苗表达体系具备高效自组装能力,独立开发生产工艺具备高纯度高均一性特点。
参考文献
[1] UF-developed mRNA vaccine triggers fierce immune response to fight malignant brain tumor. UF Health Cancer Institute
[2] Christian J. Maine, Gaelle Picarda, Shigeki J. Miyake-Stoner et al. Durability of next-generation self-replicating RNA vaccine RBI-4000: a phase 1, randomized open label clinical trial. Nature. Published 2025 Sep 24.
[3] FDA Authorizes Updated Novavax COVID-19 Vaccine to Better Protect Against Currently Circulating Variants. U.S.FOOD&DRUG官网
[4] Summary of VAX-31 Adult 50+ Phase 1/2 Study Topline Data Findings. Vaxcyte官网
[5] Bavarian Nordic官网
[6] AstraZeneca官网
[7] Breakthrough aerosol human infection model gives hope for future tuberculosis vaccine development. University of Oxford News.
[8] Lin H Chen, Andrea Fritzer, Romana Hochreiter et al. From bench to clinic: the development of VLA1553/IXCHIQ, a live-attenuated chikungunya vaccine. Journal of Travel Medicine. Published 2024 Sep 10.
[9] Pedro Cahn, Luis Barreto, Maria Ines FigueroaImmune et al. response induced by the recombinant novel coronavirus vaccine (Adenovirus type 5 vector) (Ad5-nCoV) in persons living with HIV (PLWH). Plos One. Published 2025 Jun 11.
[10] 中国食品药品国际交流中心官网
