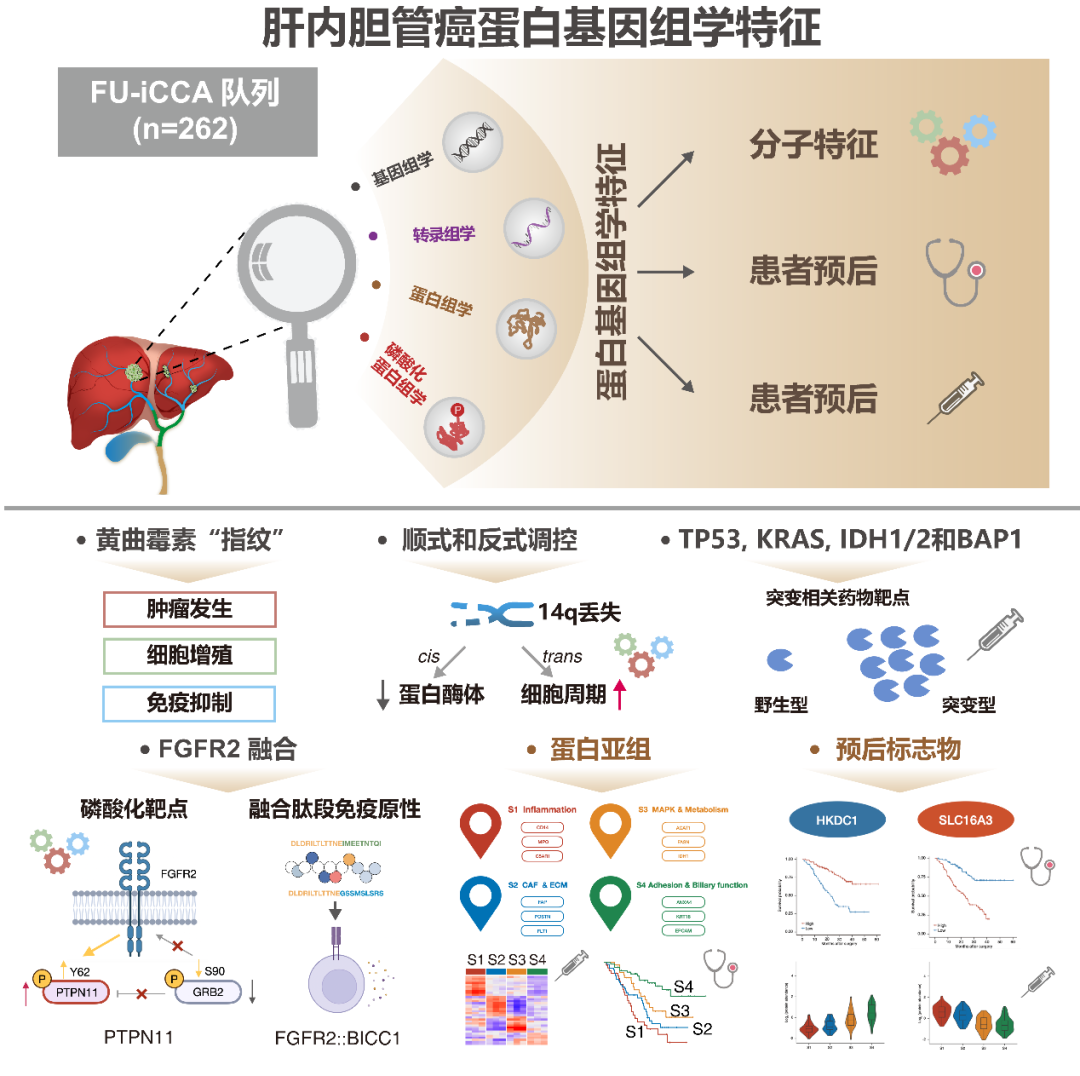
2021年12月30日,复旦大学附属中山医院樊嘉院士、中国科学院上海药物研究所周虎研究员、中国科学院分子细胞科学卓越创新中心高大明研究员和复旦大学附属中山医院高强教授课题组,在Cancer Cell上发表重磅级研究成就成果“Proteogenomic characterization identifies clinically relevant subgroups of intrahepatic cholangiocarcinoma”。此项研究是樊嘉院士团队继2019年肝细胞癌分子分型登顶国际顶刊Cell、以及2019与贺福初院士团队合作的早期肝细胞蛋白组登顶Nature之后的又一力作。
肝内胆管癌(iCCA)是第二常见的原发性肝恶性肿瘤。在未来20至30年,iCCA的发病率预计将在全球范围内增加多达10倍,但治疗策略仍然有限。大多数患者通常是在晚期确诊的,此时可用的系统疗法的有效性有限。因此,迫切需要对iCCA的发病机制进行更深入的了解,以帮助确定合适的治疗靶点。研究团队基于基因组、转录组、蛋白质组和磷酸化修饰组、微生物组等多组学技术对262例肝内胆管癌患者癌与癌旁组织进行联合分析,整合的蛋白质基因组分析表明,遗传改变可能驱动表型扰动,并揭示了具有不同特征和预后的疾病亚群,这描述了iCCA发病机制的复杂机制,为未来的精准治疗探索提供了前景。

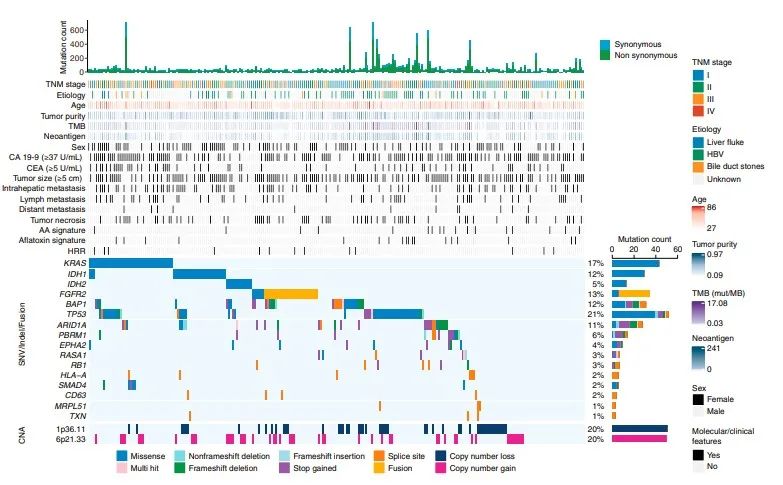
01中国肝内胆管癌(iCCA)的蛋白质基因组图谱
为了描述中国iCCA的蛋白质基因组图谱,前瞻性收集了262例未接受治疗的iCCA肿瘤和成对的邻近非肿瘤肝组织(复旦大学[FU]iCCA队列),共鉴定出12,197个非同义体点突变和603个突变,10529个蛋白和62879个磷酸位点。在所有的214个样本中定量了5690个蛋白和2761个磷酸化蛋白。在蛋白质水平上共确认了1413(1.60%)非同义体细胞变异。FU-iCCA基因改变的情况与之前的报道大体一致,发现了16个显著改变的驱动基因,包括tp53、KRAS、FGFR2、IDH1/2、BAP1、ARID1A和pbrm1。值得注意的是,FU-iCCA队列比由西方iCCA人群组成的MSKCC队列显示更高的KRAS突变频率,更低的IDH1,ARID1A和TERT突变频率。在FU-iCCA队列的7.1%和Zou等人队列9.7%的样本中观察到黄曲霉毒素特征,这两组均为中国队列,但在三个西方队列中均不存在。马兜铃酸(AA)特征也观察到了类似的趋势。具有黄曲霉毒素和AA特征的样本,TMB和新抗原负荷显著升高。TP53突变,尤其是R249S突变与黄曲霉毒素特征显著相关,这与之前的报道一致,黄曲霉毒素可诱导R249S改变,提示黄曲霉毒素在iCCA致癌性中发挥作用。
02多组学分析体细胞拷贝数变化
最常见的增生发生在染色体6p21.33(43.5%)和1q21.3(33.2%),最常见的缺失发生在染色体5q23.3(20.2%)和1p36.11(20.2%),这与之前的研究一致。39.3%(101/253)的FU-iCCA至少存在1个可操作的基因突变,其中突变61例,高TMB 9例,融合32例,扩增4例。这些拷贝数改变(CNAs)在mRNA、蛋白质和磷酸化蛋白分别观察到总计3981、1081和408个显著的顺式相关性,在所有3个组学一致的只有194个显著的顺式相关性。总共有963个蛋白质同时显示了CNA-mRNA和CNA-蛋白顺式调控作用,主要富集在代谢、生物合成和蛋白质加工途径中。在723个癌症基因普查(CGC)中,15个CGC基因显示了显著重叠的CNA-mRNA和CNA-蛋白调控。反式调控的前10事件中,其中MDM4扩增与免疫治疗的高进展相关。在染色体1p和14q中,显示出数量最多的CNA-蛋白和CNA-mRNA反式调控事件。配对的转录组和蛋白质组数据的相关性分析显示,5434对mRNA-蛋白中97.15%呈正相关,2.85%呈负相关。这些强mRNA-蛋白正相关性在代谢和造血细胞系通路中富集,而那些弱相关性或负相关性涉及核糖体、剪接体和氧化磷酸化过程。

03蛋白质基因组关联分析
重点分析4个突变最显著的驱动基因(TP53、KRAS、IDH1/2和BAP1)。在FU-iCCA队列中,TP53和KRAS突变与较差的生存期显著相关,而BAP1或IDH1 /2突变与患者生存期无关。TP53突变与细胞周期、药物代谢、吞噬小体和碳代谢通路上调相关,与ECM-黏着斑、PI3K-AKT和Hippo-YAP信号通路下调相关。KRAS突变与炎症-感染和ECM-黏着斑蛋白增加有关,与细胞周期通路中的蛋白减少有关。有趣的是,队列中的10/215名iCCA患者存在TP53和KRAS共突变,且生存率明显低于TP53或KRAS单突变患者。TP53和KRAS共突变可能通过整合素-FAK-SRC途径促进iCCA的转移和进展。在BAP1突变和IDH1/2突变肿瘤中,ECM和胆汁分泌通路是相互活跃的,而吞噬体、炎症和MAPK通路仅在其中一种肿瘤类型中相对活跃。对患者来源的原发癌细胞株进行RNAi和化学抑制剂治疗,成功验证了细胞周期相关因子、ECM相互作用和激酶信号因子等治疗靶点。
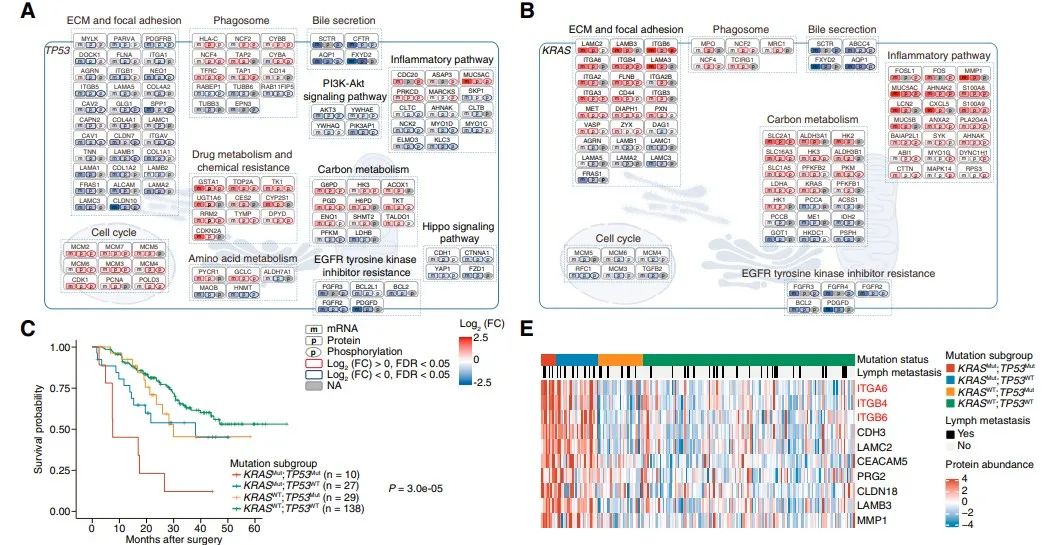
04与FGFR2变化和KRAS突变相关的磷酸化蛋白组畸变
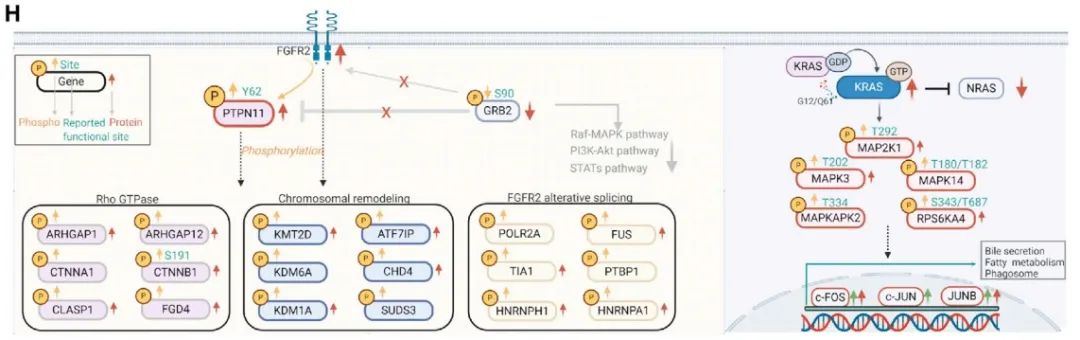
FGFR2的改变和KRAS突变可能会影响MAPK、PI3K-AKT-mTOR和Rho GTPase通路, 我们研究了有和没有这些改变的肿瘤中显著改变的磷酸位点及其相应的蛋白表达。KRAS突变的肿瘤表现出明显的MAPK通路级联激活,如MAPK14在T180和Y182位点磷酸化,MAP3K2在S514位点磷酸化,RPS6KA4在S343和T687位点的磷酸化。与之相反,FGFR2突变的肿瘤MAPK通路轻微下调,而Rho GTPase通路显著上调。此外,FGFR2改变的肿瘤表现出显著的PTPN11 (Y62)和TLN1 (Y70)酪氨酸磷酸化,在蛋白水平上观察到相似的趋势。除了FGFR2抑制剂外,抑制PTPN11可能是一种有希望的治疗FGFR2改变人群的治疗策略。
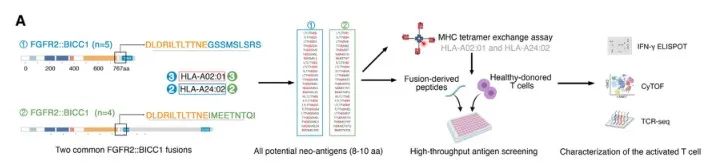
05鉴定来自FGFR2::BICC1融合和相应T细胞应答的潜在新表位
基因融合可以产生个性化免疫治疗的候选多肽。对于两个最常见的FGFR2::BICC1融合蛋白,通过四聚体交换实验,一组合成的肽被成功地交换成HLA-A02:01和HLA-A24:02四聚体。此外,我们还生成了iCCA细胞株HuCCT1和HCCC-9810,它们异位表达FGFR2:BICC1融合蛋白。MHC-I免疫肽直接检测FGFR2:BICC1过表达的HuCCT1细胞的融合肽LTLTTNEIME。这些结果支持了融合多肽可以由相应的HLA等位基因表达。来自三个健康供者的外周血单核细胞(PBMCs)被用于体外刺激新抗原特异性T细胞反应,与上述融合肽共培养。当供者1和供者2的外周血单核细胞与多肽32和33共培养,IFN-γ分泌显著上调,而供体3对这些多肽均无反应。尽管供体间存在异质性,但低频率的新表位T细胞反应性为iCCA融合患者克服免疫编辑和耐药性提供了有价值的信息。
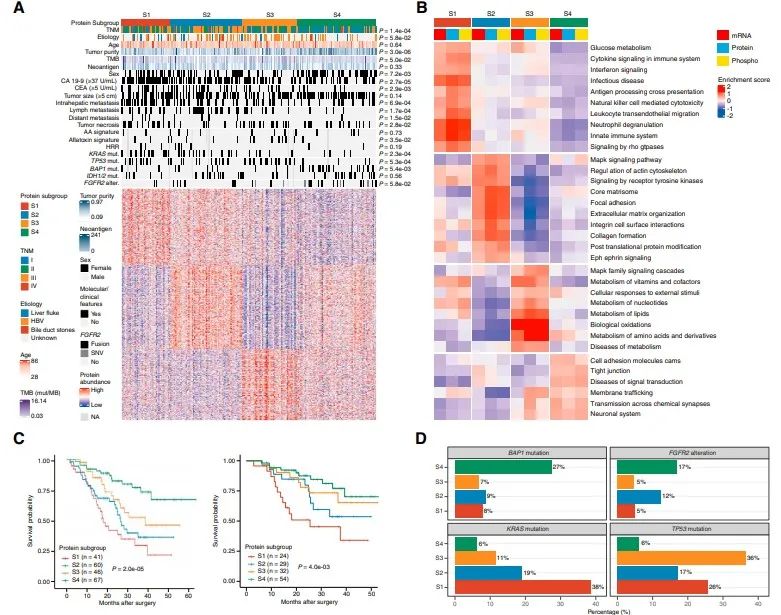
06具有明显生物学和临床特征的蛋白质组亚群
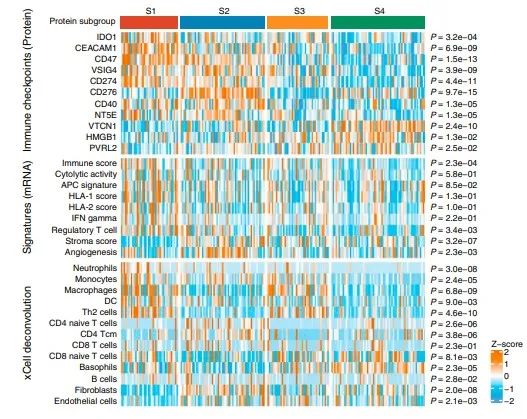
对1376个变化的蛋白进行聚类,鉴定出4个不同的蛋白质组亚群(S1-S4),这些蛋白具有不同的临床、基因组、免疫学和微环境特征。S1中CD14、MPO、C5AR1等炎症蛋白表达最为丰富。S2与癌症相关的成纤维细胞和ECM相关的蛋白水平最高,包括FAP、POSTN和FLT1。S3的特征是MAPK和代谢蛋白(如ACAT1、FASN和IDH1)升高。S4保留了最大限度的粘附蛋白和胆道特异性蛋白的表达,如ANXA4、KRT18和EPCAM。
临床上S1多为CA19-9水平升高、肿瘤坏死、肝内转移的肿瘤。S2有较高的淋巴结转移。S3以HBV感染患者为特征。S4主要富集于CA19-9水平较低、转移较少的患者。4个蛋白质组亚组的总生存期(OS)差异显著,S1-S4的中位OS分别为17.2、25.3、36.7和>60个月。每个亚组都显示了不同的周期性改变的基因。KRAS突变在S1中显著富集,炎症通路上调。S3中以TP53突变为主,并伴有细胞周期和MAPK信号通路的丰富。FGFR2突变、BAP1突变和IDH1 /2突变在S4中最常见,部分与胆汁分泌升高相关。
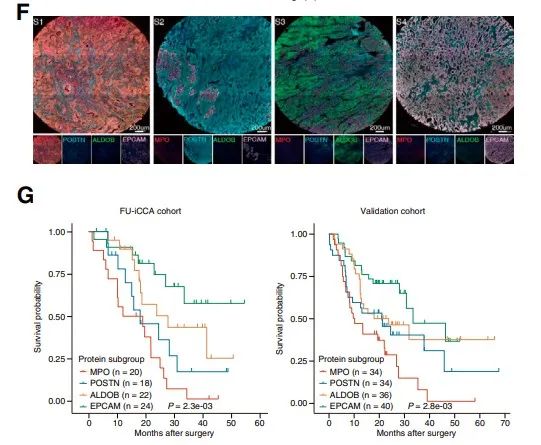
四个亚组特异性标志物MPO(中性粒细胞)、POSTN(成纤维细胞)、ALDOB(代谢)和EPCAM(胆道)分别代表炎症(S1)、间充质(S2)、代谢(S3)和分化(S4)。在FU-iCCA队列(n = 84)和验证队列(n = 144)中,通过多重免疫染色测量的4个标记物的表达可以分层患者的生存。同时,通过mRNA和磷酸化蛋白的聚类,我们还分别鉴定出三个具有显著预后值的转录组亚组和三个磷酸化蛋白组亚组。转录组和磷酸化蛋白质组的分类与蛋白质组的聚类有部分重叠和不同的分子特征。
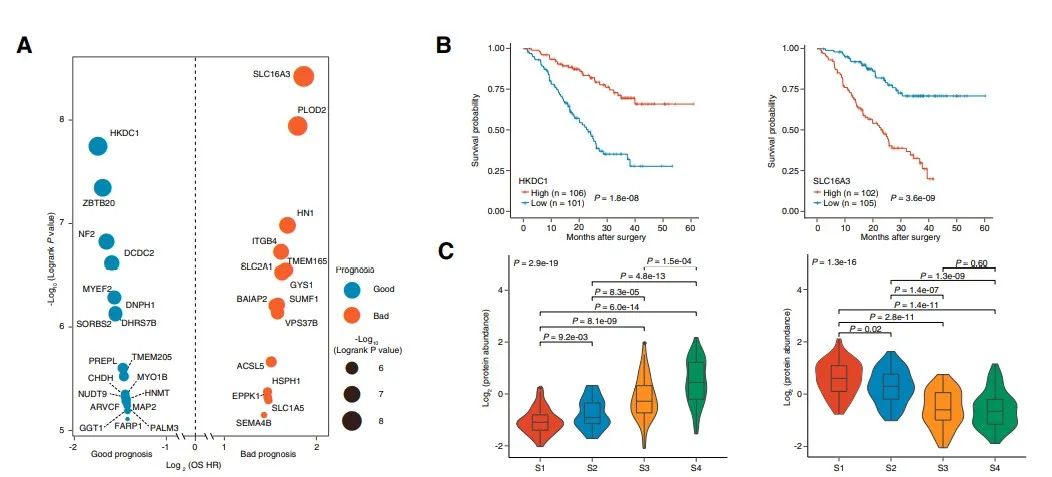
07预后蛋白质组学生物标志物的鉴定和验证
监督分析来识别预后生物标志物,通过严格的筛选过程发现19个预后良好的蛋白和15个预后不良的蛋白。其中,HKDC1和SLC16A3在FU-iCCA队列中分别与患者生存呈正相关或负相关,与常规临床病理特征无关,在四个蛋白质组亚组间存在显著差异,S1中SLC16A3表达上调,S4中HKDC1表达上调。在另一个独立的iCCA队列中,通过免疫染色检测HKDC1低表达和SLC16A3高表达分别预示较差的临床结果。实验结果表明,HKDC1和SLC16A3作为强有力的预后标志物,在iCCA中分别作为抑癌因子和强致癌因子。
08整合微生物组分析到蛋白质基因组图谱
为了研究iCCA组织细菌与癌症进展之间可能的关系,16S rRNA测序获得了从4个蛋白质组亚组中随机等分选择的80对iCCA的微生物群组成。几种不同的测量肿瘤微生物alpha多样性的方法均发现alpha多样性从S1的最高到S4的最低呈下降趋势。然而,肿瘤与相邻肝脏组织间的微生物alpha多样性无显著差异。在4个亚群中,共有12个属被鉴定为差异丰富。“transkingdom”相关分析显示,在S1和S3中OTUs与亚群特征蛋白之间存在强烈的正相关,而在S2和S4中存在负相关。宏基因组功能分析显示,来自四个亚组的KEGG通路模块丰富,如生物合成和炎症通路。因此,这四个蛋白质组亚群具有不同的肿瘤微生物多样性、组成和功能,可能在免疫和代谢重塑中发挥重要作用。
结 论
利用262例患者的配对肿瘤和邻近肝组织对肝内胆管癌(iCCA)进行了蛋白质基因组表征,揭示了iCCA发病机制的特征。黄曲霉毒素特征与肿瘤的发生、增殖和免疫抑制有关。突变相关的信号特征显示TP 53和KRAS突变可能通过整合素- FAK- SRC途径促进iCCA转移。FGFR2融合激活Rho GTPase通路,可能是新抗原的潜在来源。蛋白质组分析识别出4个患者亚群(S1-S4),并具有亚群特异性的生物标志物。这些蛋白质组在预后、基因改变、微环境失调、肿瘤微生物组成和潜在的治疗方面具有明显的特征。SLC16A3和HKDC1被进一步鉴定为与iCCA细胞代谢重编程相关的潜在预后生物标志物。本研究为研究人员和临床医生进一步确定iCCA的分子发病机制和治疗机会提供了宝贵的资源。
吉凯基因凭借多年在靶标筛选及验证服务领域的技术积累,建立的标准化 、工程化 、系统化的GRP平台,为中国研究型医生提供科研服务,加快科研成果转化。其中,多组学平台包含蛋白质组学平台和单细胞测序平台:
·蛋白质组学平台拥有多台timsTOF Pro、Exploris 480高精度质谱仪,专业的Spectronaut Plusar、Mascot等分析软件,提供专业的4D、DIA、TMT、PRM、磷酸化修饰组等检测服务,强大的机器学习算法、IPA分析、蛋白基因组分析服务,系统的生物标志物、分子分型、药物靶点、基因功能研究等解决方案,真正让广大研究型医生的科研工作更省心、更省力、更高效;
·单细胞测序拥有10x和BD两个平台,提供单细胞RNA-seq、单细胞核测序、单细胞混样RNA-seq、单细胞(RNA+ATAC)、空间转录组测序等服务。
