铁死亡小知识
■ 异常代谢和生化过程导致的急性和慢性细胞应激可能触发普遍的非凋亡形式的细胞死亡,即铁死亡,最早于2012年被Scott J Dixon提出,一种铁依赖的,区别于细胞凋亡、细胞坏死和细胞自噬的新的细胞程序性死亡模式,但有关如今描述的具有铁死亡特征的细胞死亡的报道可以追溯到上世纪50年代。
■ 谷胱甘肽的耗竭,谷胱甘肽过氧化物酶(GPX4)活性下降,细胞抗氧化能力降低,致使脂质过氧化与代谢功能障碍,脂质活性氧(ROS)增多,从而引发铁死亡。铁死亡的敏感性与许多生物过程紧密相关,包括氨基酸、铁和多不饱和脂肪酸代谢,以及谷胱甘肽、磷脂、NADPH和辅酶Q10的生物合成,并与哺乳动物退行性疾病、肿瘤、中风、脑出血、外伤性脑损伤、局部缺血-再灌注损伤和肾衰竭相关的病理性细胞死亡有关。
作为一种新的细胞死亡机制,近年来,铁死亡引起了学术界的广泛关注。2020年12月一篇发表在《Cell Metabolism》的综述,详细介绍了细胞内几种可直接影响脂质过氧化和铁死亡敏感性的代谢途径,如(硒)硫醇代谢、脂肪酸代谢、铁处理、甲戊酸途径和线粒体呼吸等,并总结了目前发现的三个主要铁死亡抑制系统,最后探讨了铁死亡在人类疾病发展预防治疗方面的应用。

一、影响细胞对铁死亡易感性的代谢过程
巯基依赖的氧化还原系统
含硫醇的三肽谷胱甘肽(GSH)是哺乳动物细胞中主要的抗氧化剂,也是GPX4的首选底物。导致谷胱甘肽耗尽的条件直接影响GPX4的活性和稳定性,从而使细胞更易发生铁死亡。GSH的消耗也可以通过限制细胞内半胱氨酸(GSH生物合成的限速底物)来实现。内源性半胱氨酸主要是通过GSH-或硫氧还蛋白还原酶1 (TXNRD1)介导的胱氨酸还原而产生的,胱氨酸主要通过Xc-系统从细胞外空间输入。
细胞内半胱氨酸至少可以通过转硫途径提供。在肝细胞中同时缺乏Txnrd1和谷胱甘肽二硫还原酶(GSR)的小鼠,尽管在减少胱氨酸方面效率低下,却因为通过转硫化的膳食蛋氨酸提供了半胱氨酸。用erastin处理多日的卵巢癌细胞中,通过诱导转硫途径逐渐对胱氨酸的缺乏产生应答,在一些肿瘤细胞中,转硫作用通路不断被激活。转硫途径的酶,包括甘氨酸N-甲基转移酶(GNMT)、S腺苷同型半胱氨酸水解酶(SAHH)、胱硫醚β合酶(CBS)和胱硫醚γ裂解酶(CTH),都使肿瘤细胞对铁死亡敏感并延缓体内肿瘤生长。
硫氧还蛋白(TXN)是第二个关键的硫氧依赖抗氧化系统。在已建立的恶性肿瘤中,依赖于TXN的细胞浆系统经常被激活,同时抑制GSH和TXN通路是有效触发细胞死亡的既定途径。最近的一项研究表明,杀铁剂(一种TXN的抑制剂)确实会诱导癌细胞的铁死亡,这表明TXN系统至少在某些细胞环境中可能作为一种替代的铁死亡抑制因子。值得一提的是,一氧化氮(NO)可能通过清除脂质自由基或自由基中间体,使M1型巨噬细胞和小胶质细胞对铁死亡产生抵抗。
细胞内铁代谢:玩火者
顾名思义,铁死亡需要铁依赖的脂质过氧化和细胞破裂,铁螯合剂确实可以抑制铁死亡,而用纳米颗粒加载的铁可诱导肿瘤细胞发生铁死亡。生理条件下,位于质膜上的铁传递蛋白受体TFR1以内吞的方式摄入运载铁传递蛋白,因此TFR1被认为是铁死亡发生的标志蛋白。细胞中的铁储存在铁蛋白中,其蛋白量特别是重链的表达减少会增加铁池和细胞对铁死亡的敏感程度。相反,通过抑制铁蛋白的自噬性降解则能使细胞抵抗铁死亡。
细胞内铁输出由质膜上与多铜铁氧化酶(如铜蓝蛋白)偶联的铁输出蛋白FPN1介导。或者,含铁蛋白的多泡体和外泌体也可以向细胞外排铁。其他与铁相关的蛋白包括多聚胞嘧啶结合蛋白PCBP1和血红素氧合酶HO-1也参与了铁死亡的调节。有研究发现小鼠肝细胞特异性缺失PCBP1会导致铁池增加,并加剧肝脏中的铁死亡。近年来,GSH在调控细胞内铁稳态方面受到广泛关注,Fe2+与GSH的复合物被认为是铁池中铁的主要形式,铁与PCBP1的结合也依赖于GSH。
甲羟戊酸途径-多功能代谢物的宝贵来源
甲羟戊酸途径包括异戊烯焦磷酸(IPP)、角鲨烯、CoQ10和胆固醇的产生,对铁死亡有多方面影响。阻断该途径限速酶的他汀类药物会干扰GPX4的有效翻译,从而增加细胞对铁死亡的敏感性;角鲨烯被认为至少在癌细胞中具有抵抗铁死亡的活性;胆固醇也参与了铁死亡,外源性胆固醇氢过氧化物以剂量依赖性方式诱导细胞死亡,而GPX4活性的降低加剧了这一过程,而GPX4的过表达能极大地提高细胞对氢过氧化胆固醇诱导的氧化性细胞死亡的抵抗力。胆固醇,特别是7-脱氧胆固醇(胆固醇前体)是脂质过氧化和铁化作用的潜在调节剂。
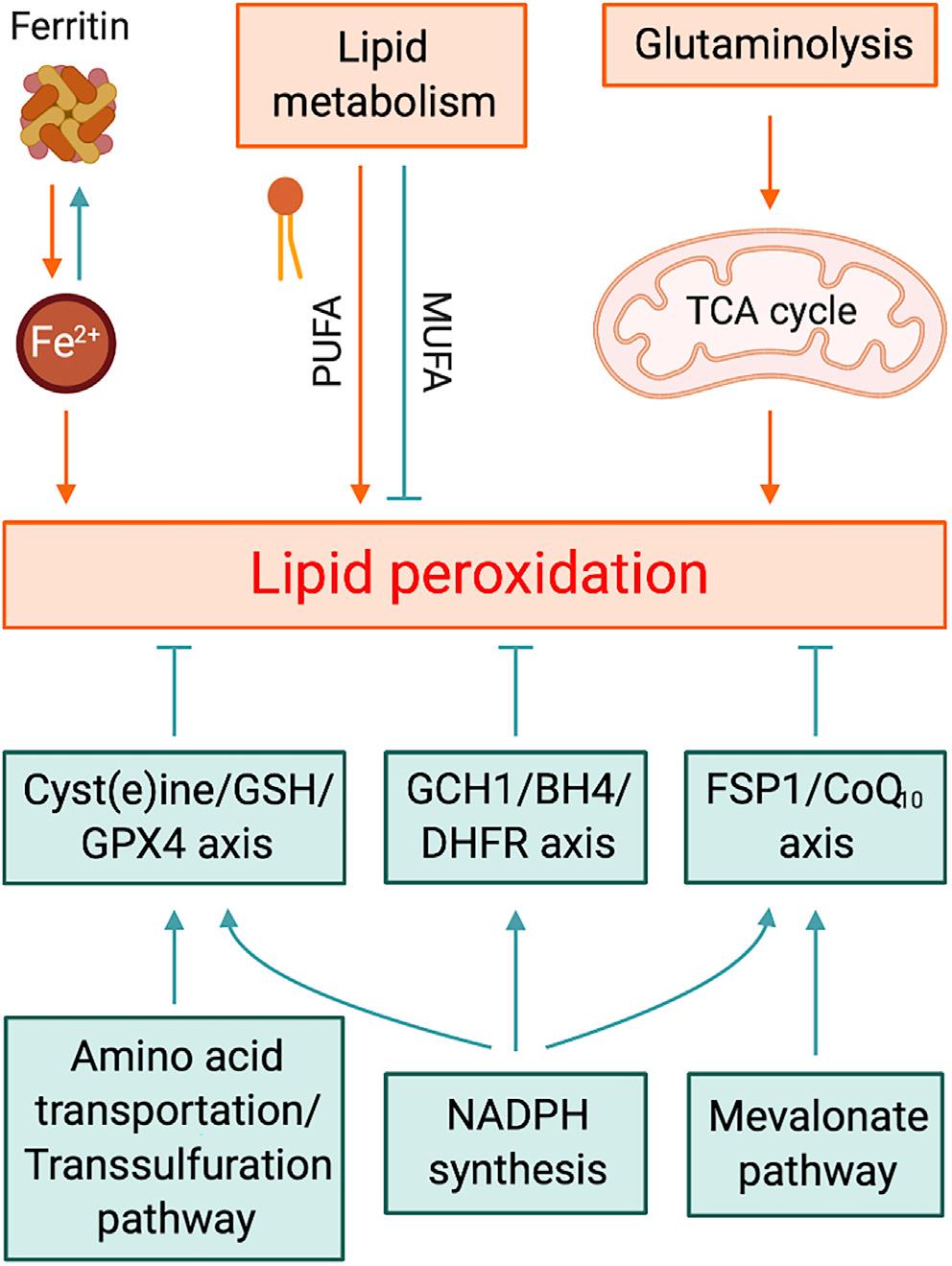
图1. 影响细胞对铁死亡易感性的代谢过程
铁死亡中线粒体的角色
目前,学术界对于线粒体究竟是否直接参与铁死亡仍存在一些争议。最近一项研究提出线粒体对erastin或胱氨酸剥夺引起的铁死亡是不可或缺的,而对于RSL3引起的铁死亡可有可无。研究人员认为,线粒体可能通过其他未知因素或者代谢途径参与铁死亡。
线粒体的铁死亡促进效应可能归因于线粒体呼吸产生的ROS,但线粒体呼吸作用为何会失控呢?一方面,系统Xc-抑制或胱氨酸剥夺可导致GSH锐减,从而削弱其对ROS的清除能力;另一方面,系统Xc-的失活可导致细胞内谷氨酸的蓄积,并转化生成α-酮戊二酸(α-KG),后者通过促进TCA循环,导致线粒体膜电位超极化。在缺乏谷氨酰胺的情况下,仅胱氨酸饥饿不能触发铁死亡,而提供α-KG可恢复细胞死亡;反过来,胱氨酸存在的情况下,补充α-KG也不能引发铁死亡。表明线粒体呼吸失调是抗氧化系统和由谷氨酰胺分解引起的TCA循环两者此消彼长的结果。
对谷氨酰胺分解或TCA循环的调节可能会影响细胞对铁死亡的敏感性。例如抗肿瘤药物大黄素甲醚8-氧-β-葡萄糖苷可升高谷氨酸酶GLS2的水平而促进铁死亡。此外,富马酸水合酶突变或者α-KG脱氢酶E3敲低的癌细胞可以抵抗胱氨酸剥夺诱导的铁死亡。
NADPH:预防铁死亡
NADPH对铁死亡的重要性不单单只是供应GSH和TXN系统这么简单,它对甲羟戊酸生物合成和脂肪酸的从头合成和延伸都是举足轻重、动关大局的存在。NADPH的基础水平可用作生物标志物衡量各种癌细胞系对铁死亡的敏感性,NADPH的耗竭会促进细胞发生铁死亡。
NADPH在铁死亡调控中具有双重作用。许多途径都可生成NADPH,如磷酸戊糖途径(PPP)、NADH磷酸化途经以及从异柠檬酸转化的α-KG途径等,其中PPP正向调控铁死亡,另外两个则相反。这种看似矛盾的结果可能归因于各自途径中酶的亚细胞分布不同,以及各途径所生成的产物不同。
多不饱和脂肪酸代谢—死神油腻的一面
最初研究认为含花生四烯酸(AA)或肾上腺酸的磷脂酰乙醇胺(PE)是铁死亡中磷脂/脂质过氧化的主要底物,而近期数据则指向广泛的多不饱和脂肪酸(PUFAs)。哺乳动物细胞中的PUFAs主要为食源性必需脂肪酸(亚油酸和α-亚麻酸)经去饱和酶和延伸酶的协同作用转化而来。去饱和酶2敲低的肝癌细胞能够抵抗RSL3诱导的脂质过氧化,与PUFAs延伸有关的丙二酰辅酶A的合成途径对铁死亡起关键性的正向调控,此外,丙二酰辅酶A对脂肪酸β氧化的抑制作用也将促进铁死亡的发生。总之,操纵PUFA的合成或降解过程将最终影响细胞对铁死亡的敏感性。
在铁死亡情况下,脂质过氧化影响的主要是酯化的PUFA,而非游离的PUFA。细胞除了依靠磷脂酶PLA2和溶血磷脂酰丝氨酸脂酶ABHD12水解磷脂上的PUFA来避免脂质过氧化,也可以利用外源性单不饱和脂肪酸(MUFA)取代磷脂PUFA。此外,MUFA生物合成需要硬脂酰CoA去饱和酶(SCD)将饱和脂肪酸转化为MUFAs。总之,磷脂中的PUFAs充足是铁死亡插手细胞命运的先决条件。
脂质过氧化—铁死亡的主要特征
目前,学术界仍在为究竟磷脂PUFA氧化物(PLOOH)是如何引发铁死亡而争论不休。或者说,脂质过氧化究竟是酶催化的还是非酶促的自氧化?究竟谁才是驱动铁死亡发生的始作俑者?酶促派的研究反复强调脂氧合酶LOX家族(尤其是ALOX15)在脂质过氧化和铁死亡中起核心作用,然而非酶促派多项研究的质疑致使LOX家族在铁死亡的主导地位不稳。首先,敲除ALOX15并不能挽救GPX4缺失引起的铁死亡及其严重病理后果。其次,对多种LOX亚型(5-LOX、p12-LOX和15-LOX-1)过表达的研究指出,无论LOX对PLOOH的原初蓄积有等何贡献,脂质的非酶促自氧化才是铁死亡的真正诱因。
铁在参与脂质过氧化上非常积极,但是它如何促成这一过程仍然难以评估。含铁酶促的活性依赖铁的参与,铁也可以通过芬顿反应促进脂质的非酶促自氧化。反正不管哪种方式,铁螯合剂都是阻挡脂质过氧化和铁死亡的有效方法。
二、铁死亡三大抑制系统
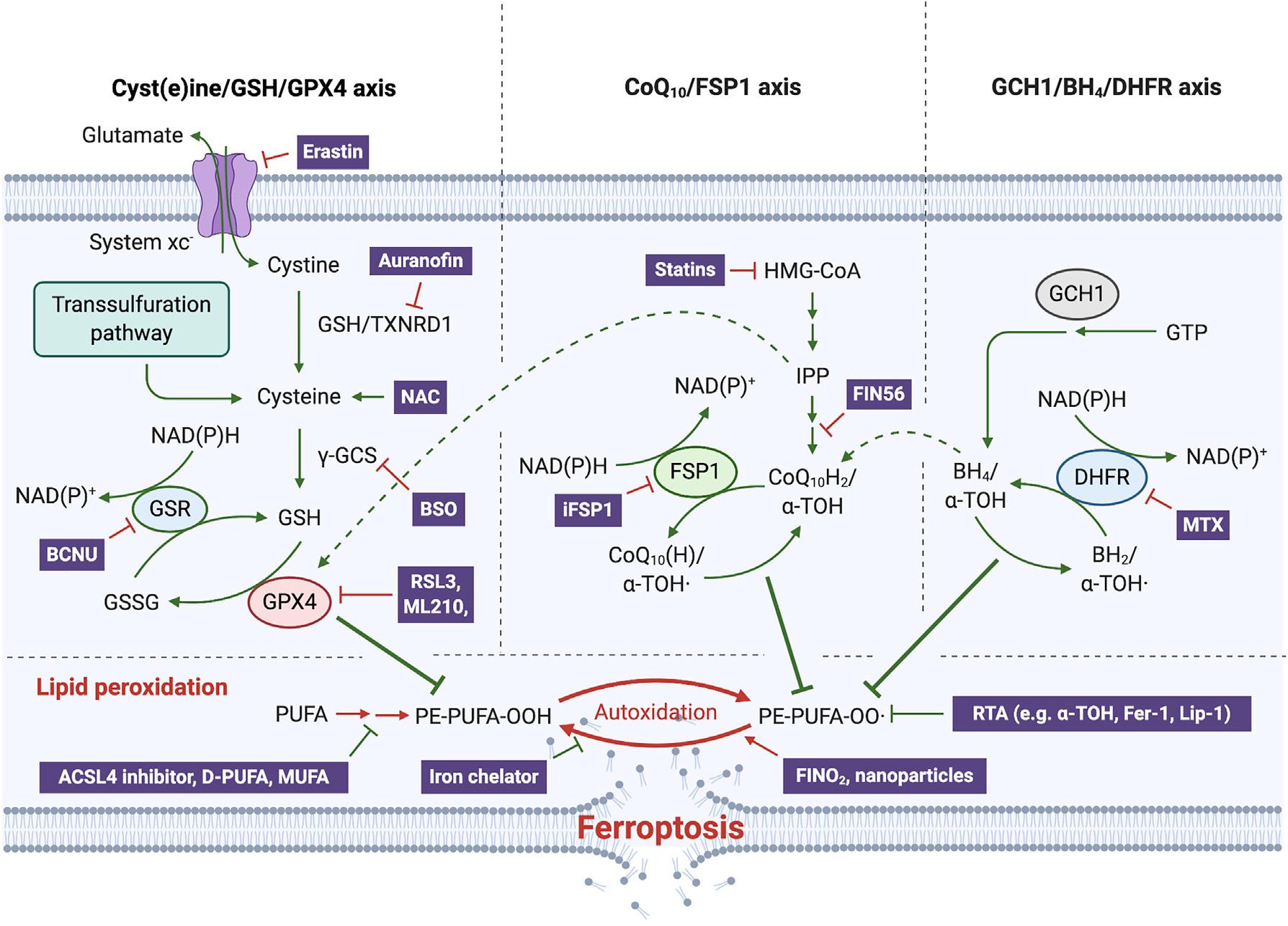
图2. 控制铁死亡的三大系统
(半)胱氨酸/GSH/GPX4轴
多年来,胱氨酸/GSH/GPX4系统被认为是防御铁死亡的唯一手段(图2),而且基因敲除和抑制GPX4活性仍然是引发铁死亡最经典的方法。GPX4是一种硒蛋白,其生物合成依赖于硒代半胱氨酸(Sec)的共翻译整合机制。敲除这一至关重要的活性位点会导致小鼠胚胎死亡,而用半胱氨酸代替Sec的小鼠在断奶前就会自发癫痫并死亡。
NAD(P)H/FSP1 /CoQ10系统
尽管FSP1对铁死亡的抑制作用最近才被发现(图2),但早在20年前就有报道这个与GPX4同样具有潜在的“NADH氧化酶功能”的未知基因所编码的蛋白可抑制细胞死亡,而由于通过摄取半胱氨酸可以抑制这种细胞死亡,因此后来被认为正是铁死亡。
FSP1属于II型NADH:醌氧化还原酶NDH-2家族,是传统线粒体呼吸系统的一个分支,催化与复合体I同样的反应,只是不泵送质子。FSP1主要定位于脂滴和质膜,是一种清除有害脂质过氧化物的系统。从机制上讲,线粒体外泛醌被FSP1从CoQ10还原而来,既可直接捕获脂质自由基,也可以通过回收α-生育酚来间接充当抗氧化的角色(图3)。
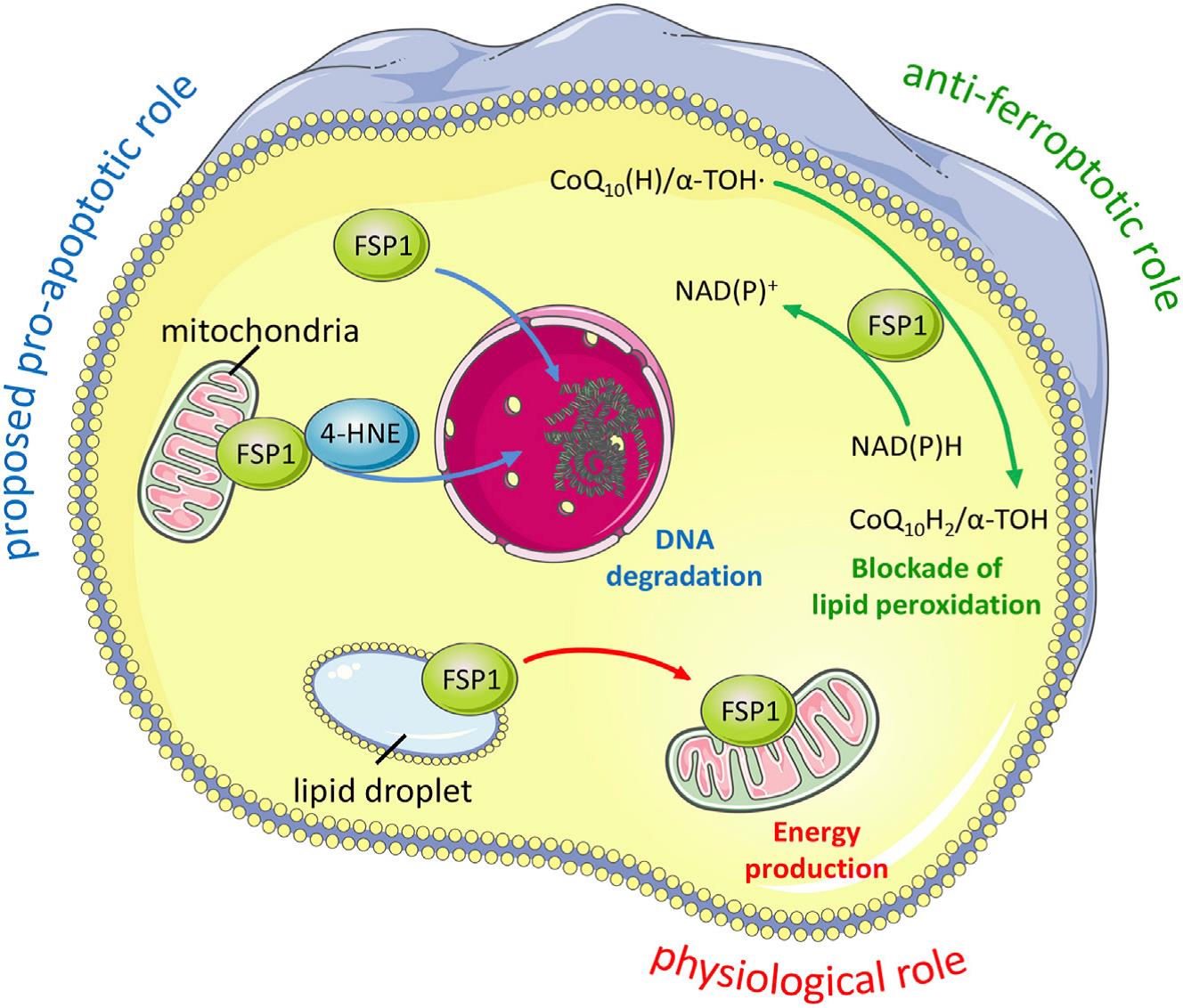
图3. FSP1对细胞死亡和生理状态的影响
GCH1/BH4/DHFR系统
近期一项研究通过CRISPR全基因组筛选并确定了一种不依赖于GPX4的铁死亡抑制基因,即鸟苷三磷酸环水解酶GCH1(四氢生物蝶呤BH4合成的限速酶)。如果阻断二氢叶酸还原酶DHFR,可协同GPX4抑制剂发挥诱导铁死亡的作用。此外,BH4还可以通过将苯丙氨酸转化为酪氨酸来促进CoQ10的合成,从而发挥抗氧化作用。
三、铁死亡与人类疾病
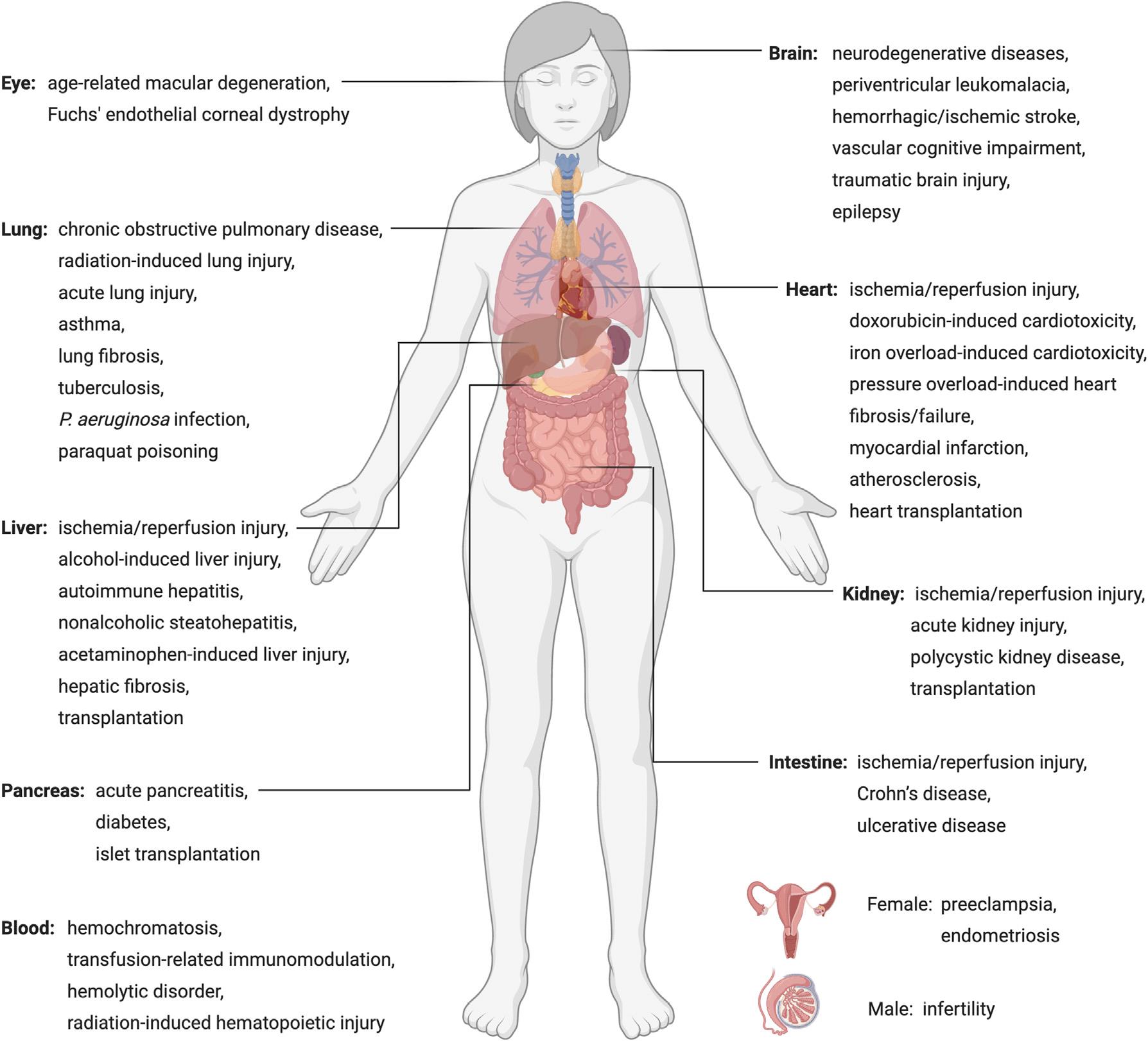
图4. 铁死亡对不同疾病患者的作用
退行性疾病
由于目前缺乏强有力的的生物标志物,铁死亡与人类疾病之间的联系仍未得到很好的阐述。因此,本文主要探讨Gpx4基因敲除的小鼠以及其他具备铁死亡特征的病理模型。GPX4的缺失导致早期胚胎死亡,肝细胞或神经元中GPX4的特异性敲除也会导致围产期或出生后死亡。他莫昔芬诱导的GPX4神经元特异性敲除会导致神经退行性病变和行为功能障碍。条件性敲除GPX4的其他类型的细胞也都表现出功能缺陷或细胞死亡。
在疾病模型中验证铁死亡的干预手段将有助于我们更好地理解铁死亡参与到这些疾病中的作用。事实上,脂质过氧化和铁积累是许多神经退行性疾病的特征,包括阿尔茨海默病、帕金森病、亨廷顿病、肌萎缩侧索硬化症、多发性硬化症等。铁死亡抑制剂已成功应用到多种动物模型的组织损伤,如脑、心脏、肠、肾脏、肝脏和缺血/再灌注相关病理变化等。
癌症的抑制
铁死亡诱导剂已被证明在抑制几种类型的癌症方面特别有效,包括三阴性乳腺癌、弥漫性大B细胞淋巴瘤、肾脏和卵巢透明细胞癌、胰腺导管腺癌、肝细胞癌、神经母细胞瘤、肾上腺皮质癌、顺铂耐药头颈部癌和耐药急性髓系白血病。由于黑色素瘤较为特殊,因其细胞的分化状态与对铁死亡诱导剂的敏感性之间似乎存在负相关。
在接受免疫、放疗和化疗的癌症患者中也检测到铁死亡, CD8+T细胞分泌的干扰素γ被证明能抑制Xc-系统的两个亚单元,从而增加癌细胞对铁死亡的敏感性。而存在于发生铁死亡的肿瘤细胞上的钙网蛋白也能促进树突状细胞的成熟和细胞毒性T细胞的浸润。铁死亡诱导剂已被证明可以增强放疗的抗肿瘤作用,而铁死亡抑制剂也可开发用于缓解放疗引起的肺损伤/纤维化和骨髓型放射病。因此,如何调节铁死亡通路,从而在放射治疗中获得最大的临床效益是一个值得进一步研究的关键问题。
绘谱帮你测
随着多种临床疾病中广泛地发现铁死亡,大量关于铁死亡与相关脂质过氧化过程的研究揭示了这样一条思路,即细胞命运决定的分子和代谢基础或能被用来改变机体生存和死亡之间的平衡状态。麦特绘谱可提供与铁死亡研究密切相关的检测服务:
■ 游离脂肪酸:基于LC-MS/MS平台可定性定量检测多种生物样本中的50+种游离脂肪酸,包括饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸;
■ 脂质组:MRM模式,同位素内标矫正可定量检测2000+种脂质,包括脂肪酰类、甘油酯类、甘油磷脂类、鞘脂类、固醇类等极性和非极性脂质。
参考文献
Jiashuo Zheng, et al. The Metabolic Underpinnings of Ferroptosis. Cell Metabolism. 2020. https://doi.org/10.1016/j.cmet.2020.10.011.
原文阅读,请长按识别下方二维码

精彩推荐
2. JCSM | 谢黎炜团队发现骨骼肌衰老伴随铁离子蓄积和骨骼肌铁死亡,为骨骼肌衰老早期预防和干预提供新思路
5. Science | 解锁--支链氨基酸与疾病的‘对话’机制


